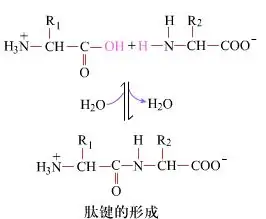
På ytan är bildningen av peptidbindningar, som ger dipeptider, en enkel kemisk process. Detta innebär att de två aminosyrakomponenterna är kopplade av en peptidbindning, en amidbindning, samtidigt som de är dehydratiserade.
Peptidbindningsbildning är aktiveringen av en aminosyra under milda reaktionsbetingelser. (A) Karboxyldel, andra aminosyran (B) Den nukleofila aktiverade karboxylgruppen bildar sedan dipeptiden (A-B). "Om karboxylkomponenten (A) inte är skyddad kan inte bildningen av peptidbindningen kontrolleras." Biprodukter såsom linjära och cykliska peptider kan blandas med målföreningar A-B. Därför måste alla funktionella grupper som inte är involverade i bildning av peptidbindning skyddas på ett tillfälligt reversibelt sätt under peptidsyntes.
Så, peptidsyntes - bildningen av varje peptidbindning - involverar tre steg för aggregering.
Det första steget är att framställa några aminosyror som behöver skydd, och den zwitterioniska strukturen hos aminosyror finns inte längre.
Det andra steget är en tvåstegsreaktion för att bilda peptidbindningar, där karboxylgruppen för den N-skyddade aminosyran först aktiveras till den aktiva mellanprodukten och sedan bildas peptidbindningen. Denna kopplade reaktion kan inträffa antingen som en stegreaktion eller som två sekventiella reaktioner.
Det tredje steget är selektivt borttagning eller fullständig borttagning av skyddsbasen. Även om allt borttagning endast kan inträffa efter att alla peptidkedjor har monterats, krävs också selektiv avlägsnande av skyddsgrupper för att fortsätta peptidsyntesen.
Eftersom 10 aminosyror (Ser, Thr, Tyr, Asp, Glu, Lys, Arg, His, SEC och Cys) innehåller funktionella grupper i sidokedjan, som kräver selektivt skydd, vilket gör peptidsyntesen mer komplicerad. Tillfälliga och semi-permanenta skyddsbaser måste särskiljas på grund av de olika kraven för selektivitet. Tillfälliga skyddsgrupper används i nästa steg för att återspegla det tillfälliga skyddet av aminosyra eller karboxylfunktionsgrupper. Semi-permanenta skyddsgrupper avlägsnas utan att störa redan bildade peptidbindningar eller aminosyrakedjor, ibland under syntes.
"Helst bör aktivering av karboxylkomponenten och efterföljande bildning av peptidbindningar (kopplingsreaktioner) vara snabba, utan racemisk eller biproduktbildning, och molära reaktanter bör appliceras för att uppnå höga utbyten." Tyvärr uppfyller ingen av de kemiska kopplingsmetoderna dessa krav, och få är lämpliga för praktisk syntes.
Under peptidsyntes är de funktionella grupperna som är involverade i olika reaktioner vanligtvis kopplade till det manuella centrumet, och glycin är det enda undantaget, och det finns en potentiell risk för rotation.
Det sista steget i peptidsyntescykeln är avlägsnande av alla skyddsgrupper. Selektiv avlägsnande av skyddsgrupper är viktigt för peptidkedjans förlängning utöver kravet för fullständigt avlägsnande av skydd vid dipeptidsyntes. Syntetiska strategier bör planeras noggrant. Beroende på det strategiska valet kan N selektivt ta bort a-amino- eller karboxylskyddsgrupperna. Termen "strategi" hänvisar till sekvensen av kondensationsreaktioner för enskilda aminosyror. I allmänhet finns det en skillnad mellan gradvis syntes och fragmentkondensation. Peptidsyntes (även känd som ”konventionell syntes”) äger rum i lösning. I de flesta fall kan gradvis förlängning av peptidkedjan endast syntetiseras genom att använda peptidkedjan för att syntetisera kortare fragment. För att syntetisera längre peptider måste målmolekylerna vara segmenterade i lämpliga fragment och fastställa att de kan minimera graden av differentiering vid C -terminalen. När de enskilda fragmenten gradvis är monterade kommer målföreningen att förenas. Strategin för peptidsyntes inkluderar valet av det bästa och mest lämpliga skyddsfragmentet, och strategin för peptidsyntes inkluderar valet av den mest lämpliga kombinationen av skyddande baser och den bästa metoden för fragmentkonjugering.
Posttid: 2025-07-02