Peptider är en klass av föreningar som bildas genom anslutning av flera aminosyror genom peptidbindningar. De är allestädes närvarande i levande organismer. Hittills har tiotusentals peptider hittats i levande organismer. Peptider spelar en viktig roll för att reglera funktionella aktiviteter för olika system, organ, vävnader och celler och i livsaktiviteter och används ofta i funktionell analys, antikroppsforskning, läkemedelsutveckling och andra områden. Med utvecklingen av bioteknik och peptidsyntessteknik har fler och fler peptidläkemedel utvecklats och applicerats på kliniken.
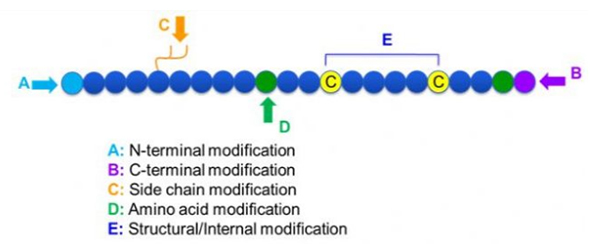
Det finns ett brett utbud av peptidmodifieringar, som helt enkelt kan delas upp i postmodifiering och processmodifiering (med användning av härledd aminosyramodifiering), och N-terminal modifiering, C-terminal modifiering, sidokedjemodifiering, aminosyramodifiering, skelettmodifiering, etc. beroende på modifieringsstället (figur 1). Som ett viktigt sätt att ändra huvudkedjestrukturen eller sidokedjegrupperna av peptidkedjor kan peptidmodifiering effektivt förändra de fysiska och kemiska egenskaperna hos peptidföreningar, öka vattenlösligheten, förlänga handlingstiden in vivo, förändra deras biologiska distribution, eliminera immunogenicitet, minska toxiska biverkningar, etc. i detta papper, flera huvudpeptidmodifieringsstrategier är introducerade.
1. Cyklisering
Cykliska peptider har många tillämpningar i biomedicin, och många naturliga peptider med biologisk aktivitet är cykliska peptider. Eftersom cykliska peptider tenderar att vara mer styva än linjära peptider, är de extremt resistenta mot matsmältningssystemet, kan överleva i matsmältningskanalen och uppvisa en starkare affinitet för målreceptorer. Cyklisering är det mest direkta sättet att syntetisera cykliska peptider, särskilt för peptider med stort strukturellt skelett. Enligt cykliseringsläget kan det delas upp i kedjetypen på sidokedjan, terminal - sidokedjetyp, terminal av terminal (slut till sluttyp).
(1) sidechain-to-sidechain
Den vanligaste typen av sidkedjan till sidokedjan cyklisering är disulfid som överbryggar mellan cysteinrester. Denna cyklisering introduceras av ett par cysteinrester som deproticeras och oxideras sedan för att bilda disulfidbindningar. Polycyklisk syntes kan uppnås genom selektivt avlägsnande av sulfhydrylskyddsgrupper. Cyklisering kan göras antingen i ett lösningsmedel efter dissociation eller vid ett fördissociationsharts. Cyklisering på hartser kan vara mindre effektiva än lösningsmedelscyklisering eftersom peptiderna på hartser inte lätt bildar cyklifierade konformationer. En annan typ av sidokedjan - Cyklisering av sidokedjan är bildningen av en amidstruktur mellan en asparagesyra eller glutaminsyrarester och basaminosyran, vilket kräver att sidokedjeskyddsgruppen måste kunna tas bort från polypeptiden antingen på hartset eller efter dissociation. Den tredje typen av sidokedjan-sidokedjecyklisering är bildandet av difenyletrar genom tyrosin eller p-hydroxifenylglycin. Denna typ av cyklisering i naturliga produkter finns endast i mikrobiella produkter, och cykliseringsprodukter har ofta potentiellt medicinskt värde. Beredningen av dessa föreningar kräver unika reaktionsbetingelser, så de används inte ofta i syntesen av konventionella peptider.

(2) Terminal-till-sidechain
Terminal-kedjecyklisering involverar vanligtvis C-terminalen med aminogruppen i lysin- eller ornitinens sidokedja, eller N-terminalen med aspartinsyran eller glutaminsyrans sidokedja. Andra polypeptidcyklisering görs genom att bilda eterbindningar mellan terminal C och serin eller treonin sidokedjor.
(3) Terminal eller topp-till-svans typ
Kedjepolypeptider kan antingen cyklas i ett lösningsmedel eller fixeras på ett harts efter sidokedjetyklering. Låga koncentrationer av peptider bör användas i lösningsmedelscentralisering för att undvika oligomerisering av peptider. Utbytet av en syntetisk ringpolypeptid från huvudet-till-svans beror på sekvensen för kedjepolypeptiden. Därför bör ett bibliotek med möjliga kedjade blypeptider först skapas, följt av cyklisering för att hitta sekvensen med de bästa resultaten innan de framställer cykliska peptider i stor skala.
2. N-metylering
N-metylering förekommer ursprungligen i naturliga peptider och införs i peptidsyntes för att förhindra bildning av vätebindningar, vilket gör peptider mer resistenta mot biologisk nedbrytning och clearance. Syntes av peptider med användning av N-metylerade aminosyrorivat är den viktigaste metoden. Dessutom kan Mitsunobu-reaktion av N- (2-nitrobensen sulfonylklorid) polypeptid-resin-mellanprodukter med metanol också användas. Denna metod har använts för att framställa cykliska peptidbibliotek som innehåller N-metylerade aminosyror.
3. Fosforylering
Fosforylering är en av de vanligaste post-translationella modifieringarna i naturen. I mänskliga celler fosforyleras mer än 30% av proteinerna. Fosforylering, särskilt reversibel fosforylering, spelar en viktig roll för att kontrollera många cellulära processer, såsom signaltransduktion, genuttryck, cellcykel och cytoskelettreglering och apoptos.
Fosforylering kan observeras vid olika aminosyrarester, men de vanligaste fosforyleringsmålen är serin-, treonin- och tyrosinrester. Fosfotyrosin, fosfothreonin och fosfoserinderivat kan antingen införas i peptider under syntes eller bildas efter peptidsyntes. Selektiv fosforylering kan uppnås med användning av rester av serin, treonin och tyrosin som selektivt avlägsnar skyddsgrupper. Vissa fosforyleringsreagens kan också införa fosforsyrogrupper i polypeptiden genom postmodifiering. Under de senaste åren har platsspecifik fosforylering av lysin uppnåtts med användning av en kemiskt selektiv Staudinger-fosfitreaktion (figur 3).

4. Myristoylering och palmitoylering
Acylering av N-terminalen med fettsyror gör det möjligt för peptider eller proteiner att binda till cellmembran. Den myridamoylerade sekvensen på den N-terminala möjliggör SRC-familjeproteinkinaser och omvänd transkriptas GAQ-proteiner att vara inriktade på att binda till cellmembran. Myristisk syra kopplades till N-terminalen i harts-polypeptiden med användning av standardkopplingsreaktioner, och den resulterande lipopeptiden kunde dissocieras under standardförhållanden och renas med RP-HPLC.
5. glykosylering
Glykopeptider såsom vankomycin och teikolanin är viktiga antibiotika för behandling av läkemedelsresistenta bakterieinfektioner, och andra glykopeptider används ofta för att stimulera immunsystemet. Eftersom många mikrobiella antigener är glykosylerade är det dessutom av stor betydelse att studera glykopeptider för att förbättra den terapeutiska effekten av infektion. Å andra sidan har det visat sig att proteinerna på cellmembranet i tumörceller uppvisar onormal glykosylering, vilket gör att glykopeptider spelar en viktig roll i cancer och tumör immunförsvar. Glykopeptider framställs med FMOC/T-Bu-metoden. Glykosylerade rester, såsom treonin och serin, införs ofta i polypeptider av pentafluorofenolesteraktiverade FMOC för att skydda glykosylerade aminosyror.
6. Isopren
Isopentadienylering sker på cysteinrester i sidokedjan nära C-terminalen. Proteinisopren kan förbättra cellmembranaffinitet och bilda protein-proteininteraktion. Isopentadienerade proteiner inkluderar tyrosinfosfatas, litet GTas, cochaperonmolekyler, kärnamina och centromera bindande proteiner. Isoprenpolypeptider kan framställas med användning av isopren på hartser eller genom att införa cysteinderivat.
7. Polyetylenglykol (PEG) modifiering
PEG -modifiering kan användas för att förbättra proteinhydrolytisk stabilitet, biodistribution och peptidlöslighet. Införandet av PEG -kedjor till peptider kan förbättra sina farmakologiska egenskaper och hämma också hydrolys av peptider med proteolytiska enzymer. PEG -peptider passerar genom det glomerulära kapillär tvärsnitt lättare än vanliga peptider, vilket kraftigt minskar njurclearance. På grund av den utökade aktiva halveringstiden för PEG-peptider in vivo kan den normala behandlingsnivån upprätthållas med lägre doser och mindre frekventa peptidläkemedel. Emellertid har PEG -modifiering också negativa effekter. Stora mängder PEG förhindrar enzymet från att nedbrytning av peptiden och reducerar också peptidens bindning till målreceptorn. Men PEG-peptidernas låga affinitet kompenseras vanligtvis av deras längre farmakokinetiska halveringstid, och genom att vara närvarande i kroppen längre har PEG-peptider en större sannolikhet att absorberas i målvävnader. Därför bör PEG -polymerspecifikationer optimeras för optimala resultat. Å andra sidan ackumuleras PEG -peptider i levern på grund av minskad njurclearance, vilket resulterar i makromolekylärt syndrom. Därför måste PEG -modifieringar utformas mer noggrant när peptider används för läkemedelsprovning.

Vanliga modifieringsgrupper av PEG -modifierare kan sammanfattas grovt enligt följande: Amino (-Amin) -NH2, Aminometyl -CH2 -NH2, Hydroxy -Oh, karbox -cooh, sulfhydryl ( --hiol) -sh, maleimid -mal, suckinimid -karbonat -sc, succinime acetat -cetat -cetat -s framgång n-hydroxysuccinimide -NHS, Acrylate-ch2ch2cooh, aldehyde -CHO (such as propional-ald, butyrALD), acrylic base (-acrylate-acrl), azido-azide, biotinyl -Biotin, Fluorescein, glutaryl -GA, Acrylate Hydrazide, alkyne-alkyne, P -toluensulfonat -ot, succinimid succinat -ss, etc. PEG -derivat med karboxylsyror kan kopplas till N -terminala aminer eller lysinsidkedjor. Amino-aktiverad PEG kan kopplas till aspartinsyra eller glutaminsyrasidokedjor. Mal-aktiverad PEG kan konjugeras till merkaptan av fullt deprotekterade cystein-sidokedjor [11]. PEG-modifierare klassificeras vanligtvis enligt följande (Obs: MPEG är metoxi-PEG, CH3o- (CH2CH2O) N-CH2CH2-OH):
(1) Rak kedjepinnmodifierare
MPEG-SC, MPEG-SCM, MPEG-SA, MPEG-OTS, MPEG-SH, MPEG-ALD, MPEG-BUTYRALD, MPEG-SS
(2) Bifunktionell PEG -modifierare
HCOO-PEG-COOH, NH2-PEG-NH2, OH-PEG-COOH, OH-PEG-NH2, HCL · NH2-PEG-COOH, MAL-PEG-NHS
(3) förgreningspinnmodifierare
(MPEG) 2-NHS, (MPEG) 2-ALD, (MPEG) 2-NH2, (MPEG) 2-MAL
8. Biotinisering
Biotin kan vara starkt bundet med avidin eller streptavidin, och bindningsstyrkan är till och med nära kovalent bindning. Biotinmärkta peptider används vanligtvis i immunanalys, histocytokemi och fluorescensbaserad flödescytometri. Märkta antibiotinantikroppar kan också användas för att binda biotinylerade peptider. Biotinetiketter är ofta fästa vid lysinets sidokedja eller N -terminalen. 6-aminocaproic acid används ofta som en bindning mellan peptider och biotin. Bindningen är flexibel vid bindning till underlaget och binder bättre i närvaro av steriskt hinder.
9. Fluorescerande märkning
Fluorescerande märkning kan användas för att spåra polypeptider i levande celler och för att studera enzymer och verkningsmekanismer. Tryptophan (TRP) är fluorescerande, så den kan användas för inre märkning. Utsläppsspektrumet för tryptofan beror på den perifera miljön och minskar med minskande lösningsmedelspolaritet, en egenskap som är användbar för att detektera peptidstruktur och receptorbindning. Tryptofanfluorescens kan släckas genom protonerad asatsyra och glutaminsyra, vilket kan begränsa användningen. Dansylkloridgruppen (Dansyl) är mycket fluorescerande när den är bunden till en aminogrupp och används ofta som en fluorescerande etikett för aminosyror eller proteiner.
Fluorescensresonansenergiomvandling (FRET) är användbar för enzymstudier. När FRET appliceras innehåller substratpolypeptiden vanligtvis en fluorescensmärkningsgrupp och en fluorescens-avkopplande grupp. Märkta fluorescerande grupper släcks av släckaren genom icke-foton energiöverföring. När peptiden är dissocierad från enzymet i fråga, avger märkningsgruppen fluorescens.
10. Burpolypeptider
Burpeptider har optiskt avtagbara skyddsgrupper som skyddar peptiden från bindning till receptorn. När peptiden utsätts för UV -strålning, aktiveras peptiden och återställer dess affinitet till receptorn. Eftersom denna optiska aktivering kan kontrolleras enligt tid, amplitud eller plats, kan burpeptider användas för att studera reaktioner som förekommer i celler. De mest använda skyddsgrupperna för burpolypeptider är 2-nitrobensylgrupper och deras derivat, som kan införas i peptidsyntes via skyddande aminosyrorivat. Aminosyrorivat som har utvecklats är lysin, cystein, serin och tyrosin. Aspartat- och glutamatderivat används emellertid inte vanligtvis på grund av deras känslighet för cyklisering under peptidsyntes och dissociation.
11. Polyantigenisk peptid (MAP)
Korta peptider är vanligtvis inte immun och måste kopplas till bärarproteiner för att producera antikroppar. Polyantigenpeptid (MAP) består av flera identiska peptider anslutna till lysinkärnor, som specifikt kan uttrycka immunogens med hög styrka och kan användas för att framställa peptid-bärproteinkopplingar. MAP -polypeptider kan syntetiseras genom fastfassyntes på MAP -harts. Emellertid resulterar ofullständig koppling i saknade eller trunkerade peptidkedjor på vissa grenar och uppvisar således inte egenskaperna hos den ursprungliga MAP -polypeptiden. Som ett alternativ kan peptider framställas och renas separat och sedan kopplas till MAP. Peptidsekvensen fäst vid peptidkärnan är väl definierad och kännetecknas lätt av masspektrometri.
Slutsats
Peptidmodifiering är ett viktigt sätt att utforma peptider. Kemiskt modifierade peptider kan inte bara upprätthålla hög biologisk aktivitet utan också effektivt undvika nackdelarna med immunogenicitet och toxicitet. Samtidigt kan kemisk modifiering ge peptider med några nya utmärkta egenskaper. Under de senaste åren har metoden för C-H-aktivering för postmodifiering av polypeptider utvecklats snabbt och många viktiga resultat har uppnåtts.
Posttid: 2025-07-03
